Die Sicherheit der PALYNZIQ® Injektion wurde im Rahmen der klinischen Phase-3-PRISM-Studie untersucht1,2
Bei allen 261 Patienten kam es zu mindestens einer Nebenwirkung, von denen die meisten leicht bis mittelschwer waren. Am häufigsten wurden ISR-, Arthralgie- und Überempfindlichkeitsreaktionen gemeldet1,3
- In klinischen Studien waren die Nebenwirkungsraten während der Einleitung und Titration am höchsten und nahmen mit der Zeit ab3
Nebenwirkungen bei Patienten unter Behandlung mit PALYNZIQ®3*†‡
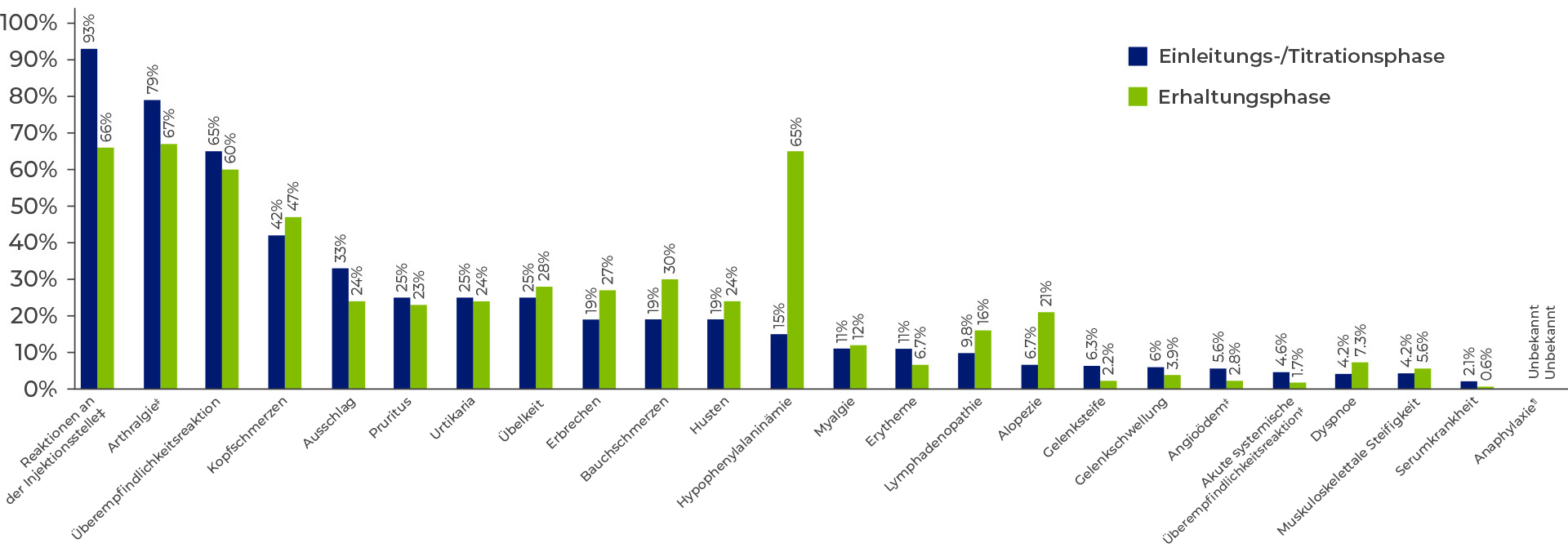

Nebenwirkungen, die bei ≥ 5% der mit PALYNZIQ® behandelten Patienten und bei Patienten mit schweren Reaktionen auftreten.1
Umfasst alle Patienten, die in Phase-2- und Phase-3-Studien ein Einleitungs- Titrations- und Erhaltungsdosierschema befolgt haben (N = 285).3
Die Einleitungs- und Titrationsphase spiegelt die Zeit vor dem Erreichen von Blut-Phe-Werten < 600 μmol/L bei stabiler Dosis (d. h. Erhaltungsdosis) wider.3
Überempfindlichkeitsreaktionen umfassen eine Gruppe von Begriffen, einschließlich akuter systemischer Überempfindlichkeitsreaktionen, und können sich als eine Reihe von Symptomen manifestieren, einschließlich Angioödem, Serumkrankheit, Hautausschlag und Urtikaria. In klinischen Studien traten bei 6% der Patienten akute systemische Überempfindlichkeitsreaktionen auf.3
In klinischen Phase-3-Studien wurden nicht-IgE-vermittelte akute Überempfindlichkeitsreaktionen beobachtet3
- In klinischen Studien mit einem Einleitungs-/Titrations-/Erhaltungsschema traten bei 6% der Patienten (16 von 285) insgesamt 25 Überempfindlichkeitsreaktionen auf3
- Bei Auftreten der Episoden oder um diesen Zeitpunkt herum wurde kein arzneimittelspezifisches lgE nachgewiesen3
- Akute Überempfindlichkeitsreaktionen traten am häufigsten in der Induktions- und Titrationsphase auf, in der Erhaltungsphase waren sie um das Sechsfache reduziert3
Immunkomplexvermittelte Überempfindlichkeitsreaktionen vom Typ III
- Überempfindlichkeitsreaktionen traten bei 75% der mit PALYNZIQ® behandelten Patienten auf3
- Die Rate der Überempfindlichkeitsreaktionen war während der Einleitungs- / Titrationsphase am höchsten und nahm während der Erhaltungsphase ab, Reaktionen können jedoch jederzeit auftreten3
- In klinischen Studien wurden Überempfindlichkeitsreaktionen mit Dosisreduktion, Behandlungsunterbrechung, Absetzen der Behandlung und / oder Begleitmedikamenten behandelt3
Strategien für das Management potenzieller akuter Überempfindlichkeitsreaktionen
Voraussetzungen
- Verordnen Sie allen mit PALYNZIQ® behandelten Patienten selbst injizierbares Epinephrin (Adrenalin). Erklären Sie dem Patienten und (gegebenenfalls) dem erwachsenen Beobachter vor der ersten Dosis, woran die Zeichen und Symptome einer akuten Überempfindlichkeitsreaktion zu erkennen sind, wie das selbst injizierbare Epinephrin (Adrenalin) richtig angewendet wird und dass nach seiner Anwendung unverzüglich ein Arzt zu rufen ist3
- Weisen Sie die Patienten an, das selbst injizierbare Epinephrin (Adrenalin) während der Behandlung mit PALYNZIQ® stets bei sich zu tragen3
Überlegungen
- Wenn der Patient selbst injiziert, muss mindestens während der ersten 6 Behandlungsmonate für mindestens 1 Stunde nach der Verabreichung von PALYNZIQ® ein Beobachter anwesend sein3
- Der Beobachter sollte in der Lage sein, Zeichen und Symptome einer akuten Überempfindlichkeitsreaktion zu erkennen und selbst injizierbares Epinephrin (Adrenalin) zu verabreichen. Er sollte wissen, dass nach einer Reaktion medizinische Notfallhilfe anzufordern ist3
- Eine Prämedikation ist während der Einleitungs- und Titrationsphase vor jeder Dosis PALYNZIQ® erforderlich und kann während der Erhaltungsphase je nach individueller Verträglichkeit erwogen werden:3
- H1-Rezeptorantagonist
- H2-Rezeptorantagonist
- Antipyretikum
Literatur: 1. Thomas J et al. Mol Genet Metab 2018;124(1):27–38. 2. Harding CO et al. Mol Genet Metab 2018:124(1):20-26 3. PALYNZIQ® Fachinformation.